در صنایع غذایی هیدروکلوئیدها با توجه به ویژگیهای سطحی و رئولوژیکی خود نقش ایفا میکنند. ویژگیهای سطحی، با سیستمهای کلوئیدی در مواد غذایی مرتبط شده که میتواند به گروههای مختلفی، بر مبنای حالات ماده در فازهای پیوسته و پراکنده، طبقهبندی شود.
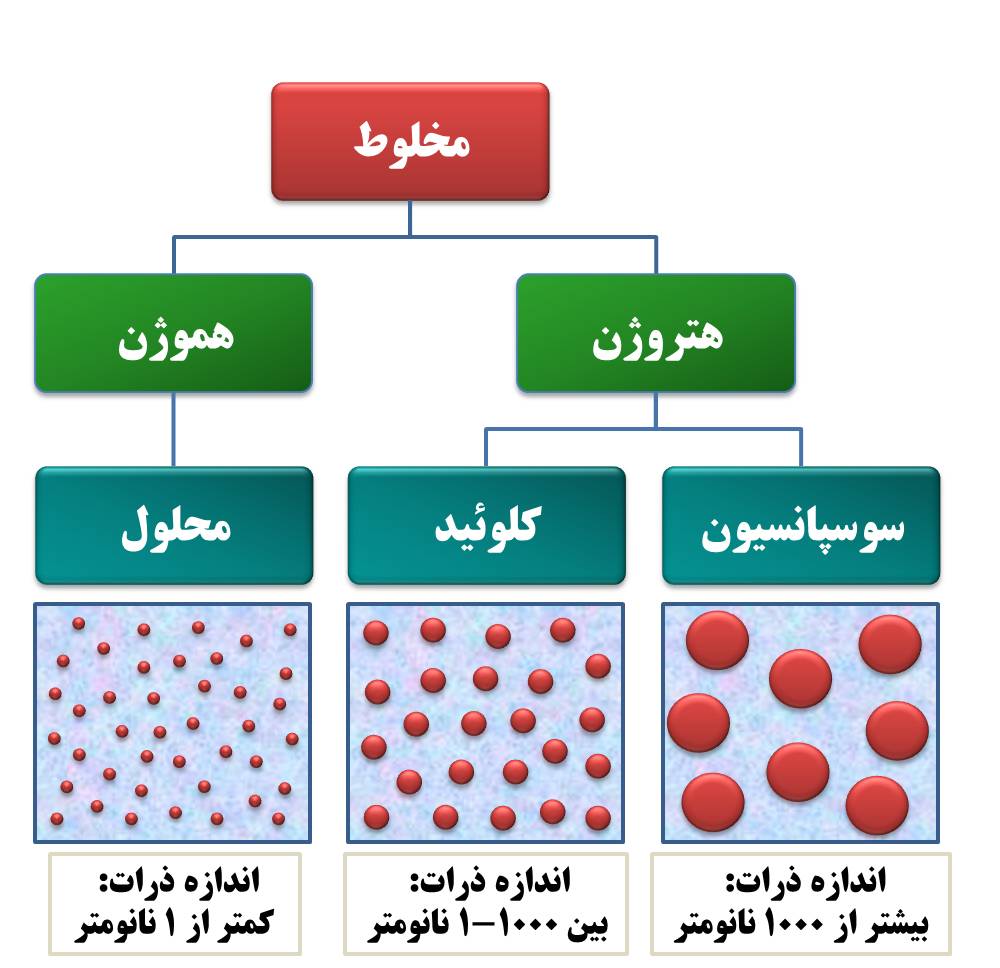
لازم به توضیح است که بیشتر مواد غذایی به فرم مخلوطها هستند و مخلوطها به دو صورت هموژن و هتروژن دیده میشوند. مخلوطهای هموژن را محلول مینامند، در حالی که مخلوطهای هتروژن به دو حالت کلوئیدی و سوسپانسیون وجود دارند. هر یک از محلولها، کلوئیدها و سوسپانسیونها میتوانند به فرم مایع، جامد یا گاز وجود داشته باشند.
یک محلول عادی، متشکل از حلال و حلشونده است. ذرات حلشونده در یک محلول عادی، معمولا مولکولها یا یونهای نرمال هستند و اندازه آنها بهطور کلی بین ۱-۰/۱ نانومتر است. سیستمهای مختلفی وجود دارند که در آنها اندازه ذرات بهطور قابل توجهی بزرگتر و در حقیقت دامنهای از یک نانومتر تا چندین میکرون است. سیستمهایی که شامل محیطی با ذرات حلشده یا پراکنده که دارای اندازهای از تقریبا ۱ نانومتر تا چندین میکرون هستند، کلوئیدها نامیده میشوند. ذرات کلوئیدی کوچکتر از ذرات درشت (coarse) بوده، قابل فیلتر هستند، اما بزرگتر از اتمها و مولکولهای کوچک میباشند.
بر مبنای اندازه ذرات، سیستمهای حاوی ذرات پراکنده میتوانند به سه دسته تقسیم شوند:
محلولهای حقیقی: محلولهای حقیقی، مخلوط یا سیستم هموژن هستند که اندازه ذرات پراکنده در آنها کمتر از ۱ نانومتر است. ذرات حلشده موجود در یک محلول حقیقی، مولکولها یا یونهای واحد بوده و بهطور همگنی در سراسر محلولها توزیع شدهاند.
این ذرات نامرئی بوده و حتی با میکروسکوپ نیز دیده نمیشوند. با توجه به اندازه بسیار کوچک ذرات پراکنده، محلولهای حقیقی از کاغذ فیلتر معمول و همچنین از میان غشاهای حیوانی عبور میکنند. کلرید سدیم، شکر و غیره، محلولهای حقیقی در آب تشکیل میدهند.
دیسپرسیونهای کلوئیدی: دیسپرسیونهای کلوئیدی سیستمهای هتروژن هستند که اندازه ذرات پراکنده در آنها بین ۱۰۰۰-۱ نانومتر است. بنابراین ذرات در یک دیسپرسیون کلوئیدی بزرگتر بوده و با عنوان ذرات کلوئیدی شناخته میشوند. گرچه ذرات کلوئیدی سایز بزرگتری دارند، اما هنوز بهاندازه کافی بزرگ نیستند که با چشم غیرمسلح دیده شوند. با این حال میتوان آنها را بهکمک الترامیکروسکوپها مشاهده نمود. دیسپرسیونهای کلوئیدی از کاغذ فیلتر معمول عبور نموده اما قادر به عبور از غشای حیوانی نیستند. صمغها بههنگام حل شدن در آب، دیسپرسیونهای کلوئیدی تشکیل میدهند. عبارتهای “دیسپرسیون کلوئیدی” و “محلول کلوئیدی” بسیاری اوقات به جای یکدیگر بهکار گرفته میشوند.
سوسپانسیونها: سوسپانسیونها نیز سیستم هتروژن هستند و ذرات بزرگتری دارند. اندازه ذرات یک سوسپانسیون بیشتر از ۱۰۰۰ نانومتر (۱ میکرون) بوده که با چشم غیرمسلح قابل رؤیت هستند. سوسپانسیونها قادر به عبور از هیچیک از غشاهای حیوانی و کاغذ فیلتر معمولی نمیباشند. دوغ، آبلیمو، شیرکاکائو، شربت خاکشیر و غیره، نمونههایی از چند سوسپانسیون هستند.
باتوجه به توضیحات بالا، دیسپرسیونهای کلوئیدی حدواسط محلولهای حقیقی و سوسپانسیونها هستند. دیسپرسیونهای کلوئیدی تنها توسط برخی مواد خاص ایجاد نمیشوند، بلکه میتوانند از هر مادهای با خردشدن یا تجمع ذرات آن ماده در محدوده اندازه ۱۰۰۰-۱ نانومتر شکل گیرند، و لذا در عمل، تمامی مواد میتوانند در شکل کلوئیدی وجود داشته باشند. بنابراین بهجای گفتن “دیسپرسیون کلوئیدی”، بهتر است که از “حالت کلوئیدی ماده” استفاده شود.
حالت کلوئیدی ماده: حالت کلوئیدی ماده، حالتی است که در آن اندازه ذرات، بین ۱۰۰۰-۱ نانومتر بوده و سیستمهایی که حاوی ذرات پراکنده در چنین محدوه اندازهای هستند، “سیستمهای کلوئیدی” نامیده میشوند.
ویژگیهای مهم محلولهای حقیقی، دیسپرسیونهای کلوئیدی و سوسپانسیونها
ویژگی محلول حقیقی دیسپرسیون کلوئیدی سوسپانسیون
1 اندازه ذره کمتر از 1 نانومتر بین 1000-1 نانومتر بیشتر از 1000 نانومتر
2 ماهیت همگن ناهمگن ناهمگن
3 قابلیت دید ذرات نامرئی قابل دید با الترامیکروسکوپ قابل دید با چشم غیرمسلح و میکروسکوپ
4 ظاهر شفاف بهطور کل شفاف اما ممکن است نیمهشفاف باشد مات
5 قابلیت فیلتراسیون بهسادگی از کاغذ فیلتر معمولی و غشای حیوانی عبور میکند بهسادگی از کاغذ فیلتر معمولی عبور نموده اما از غشای حیوانی خیر نه از کاغذ فیلتر معمول و نه از غشای حیوانی، عبور نمیکند
6 تهنشینی تحت جاذبه ذرات تهنشین نمیشوند ذرات کلوئیدی تحت جاذبه تهنشین نشده، اما میتوانند تحت سانتریفیوژِ سرعت بالا تهنشین شوند ذرات سوسپانسیون در حالت ایستا تهنشین میشوند
7 پخش ذرات بهسرعت پخش میشوند بهآهستگی پخش میشوند پخش نمیشوند
8 پراکندگی نور توسط ذرات (اثر تیندال) نور را پراکنده نمیکنند نور را پراکنده میکنند ممکن است اثر تیندال را نمایش دهند
انواع دیسپرسیونهای کلوئیدی
یک سیستم کلوئیدی متشکل از دو فاز است: فاز پراکنده یا ناپیوسته (dispersed phase) که همان ذرات یا قطرات کلوئیدی است، و محیط دیسپرسیون یا فاز پیوسته (dispersion medium) که دربرگیرنده ذرات یا قطرات کلوئیدی است. چندین سیستم کلوئیدی بسته به ماهیت فاز پراکنده و محیط دیسپرسیون وجود داشته که در جدول زیر آمده است:
انواع دیسپرسیون کلوئیدی بر مبنای حالت فیزیکی
فاز پراکنده محیط دیسپرسیون نام مثالها
جامد مایع سل محلول صمغها
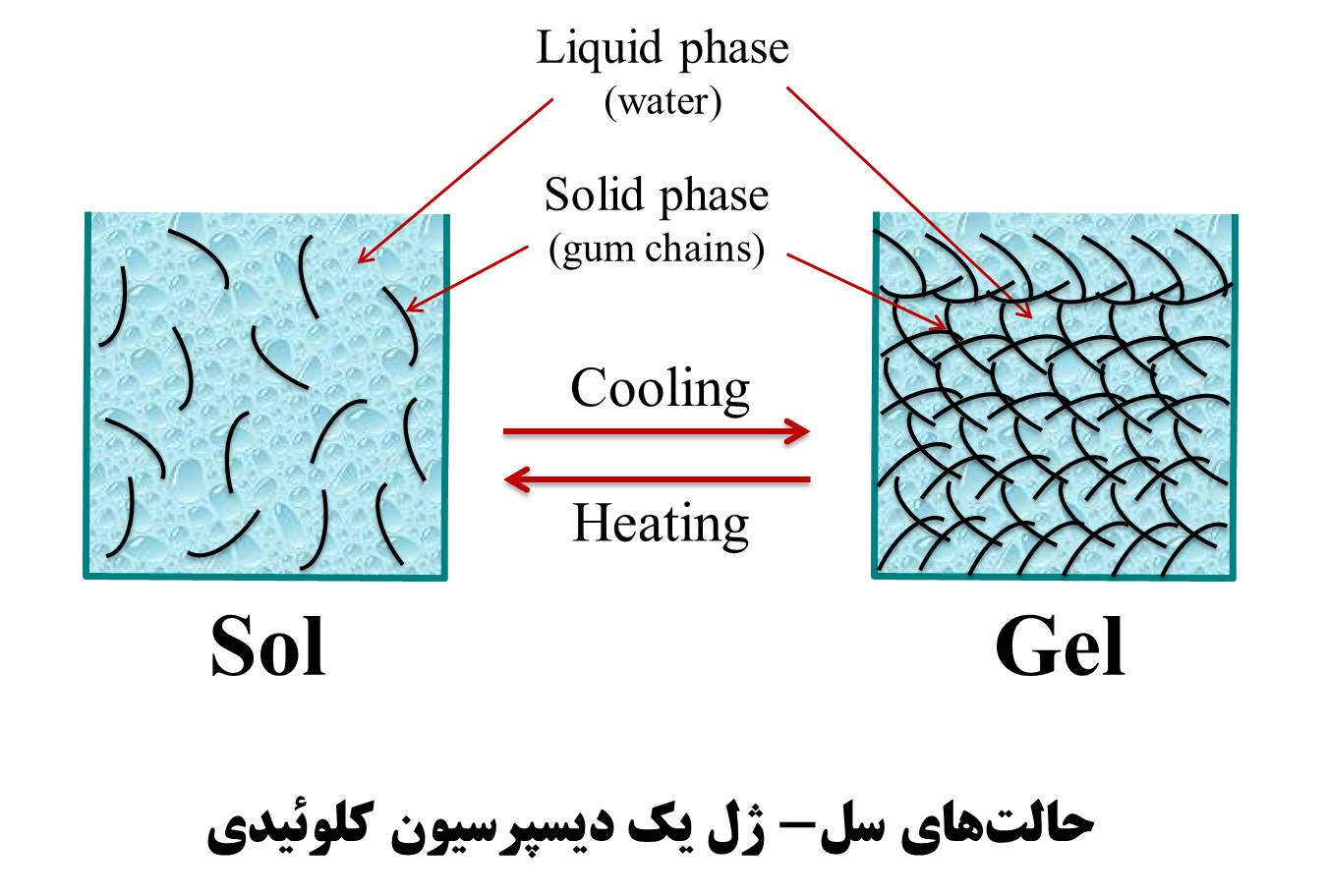
مایع جامد ژل ژل صمغها، پنیر، کره
مایع مایع امولسیون شیر، مایونز
گاز مایع کف خامه زده، سفیده تخممرغ زده
جامد جامد سل جامد آلیاژها، سنگهای قیمتی
جامد گاز آئروسل دود، باکتریهای هوا
مایع گاز آئروسل مایع ابر، مه
گاز جامد کف جامد نان، بستنی، کیک، مارشمالو
کلوئیدهایی که در آن، فاز پراکنده مایع و محیط دیسپرسیون جامد است ژل نامیده میشود و دارای ساختار سفتتری هستند، مانند پنیر. بعضی از کلوئیدها نظیر صمغها (ژلاتین، پکتین، آلژینات و ..) میتوانند به هر دو حالت سل و ژل رفتار کنند. برای مثال، در دمای بالا و غلظت کم ژلاتین، دیسپرسیون کلوئیدی به شکل سل است، اما در دمای پایین و غلظت بالای ژلاتین، سیستم کلوئیدی از حالت سل به ژل تغییر پیدا میکند.
طبقهبندی کلوئیدها بر اساس ماهیت برهمکنش بین فاز پراکنده و محیط دیسپرسیون
 سلهای حلالدوست (Lyophilic sols): این اصطلاح بهمعنی مایعدوست است. موادِ دارای ابعاد کلوئیدی که تمایل پیوندی با مایعات خاص (محیط دیسپرسیون) داشته و بهسادگی با آنها دیسپرسیونهای کلوئیدی تشکیل میدهند، کلوئیدهای حلالدوست (Lyophilic colloids) نامیده شده و سلهای ایجاد شده را، سلهای حلالدوست مینامند. صمغها نمونههای متداول از کلوئیدهای حلالدوستاند. سل صمغها در آب، سلهای پلیمرها در حلالهای آلی و غیره، بعضی از نمونههای سلهای حلالدوست میباشند. سلهای حلالدوست پایدار بوده و بهراحتی ترسیب نمییابند. در حقیقت آنها بهخودی خود پایدار هستند و نیاز به هیچ عامل پایدارکنندهای جهت حفظ و ثبات خود ندارند. یک ویژگی مهم این سلها این است که اگر فاز پراکنده بهنحوی از محیط دیسپرسیون جدا شود (با فرآیند تبخیر و خشک کردن)، فاز پراکنده دوباره میتواند بهسادگی با اختلاط با محیط دیسپرسیون به حالت سل درآید. برای همین، سلهای هیدروفیلیک یا آبدوست، با عنوان سلهای برگشتپذیر (reversible sols) نیز شناخته میشوند. صمغها، مواد ماکرومولکولی در ابعاد کلوئیدی بوده که بهدلیل داشتن تعداد زیادی گروههای هیدروکسیل، آمینو، کربوکسیلیک، و بسیاری گروههای قطبی یا یونی و هیدروفیلیک دیگر، بهراحتی با آب برهمکنش داده و در فاز آبی توزیع میشوند، از اینرو آنها را پلیمرهای هیدروفیلیک یا بهطور سادهتر “هیدروکلوئیدها” مینامند، که قادرند یک سیستم کلوئیدی برگشتپذیر (reversible colloid system) تشکیل دهند.
سلهای حلالدوست (Lyophilic sols): این اصطلاح بهمعنی مایعدوست است. موادِ دارای ابعاد کلوئیدی که تمایل پیوندی با مایعات خاص (محیط دیسپرسیون) داشته و بهسادگی با آنها دیسپرسیونهای کلوئیدی تشکیل میدهند، کلوئیدهای حلالدوست (Lyophilic colloids) نامیده شده و سلهای ایجاد شده را، سلهای حلالدوست مینامند. صمغها نمونههای متداول از کلوئیدهای حلالدوستاند. سل صمغها در آب، سلهای پلیمرها در حلالهای آلی و غیره، بعضی از نمونههای سلهای حلالدوست میباشند. سلهای حلالدوست پایدار بوده و بهراحتی ترسیب نمییابند. در حقیقت آنها بهخودی خود پایدار هستند و نیاز به هیچ عامل پایدارکنندهای جهت حفظ و ثبات خود ندارند. یک ویژگی مهم این سلها این است که اگر فاز پراکنده بهنحوی از محیط دیسپرسیون جدا شود (با فرآیند تبخیر و خشک کردن)، فاز پراکنده دوباره میتواند بهسادگی با اختلاط با محیط دیسپرسیون به حالت سل درآید. برای همین، سلهای هیدروفیلیک یا آبدوست، با عنوان سلهای برگشتپذیر (reversible sols) نیز شناخته میشوند. صمغها، مواد ماکرومولکولی در ابعاد کلوئیدی بوده که بهدلیل داشتن تعداد زیادی گروههای هیدروکسیل، آمینو، کربوکسیلیک، و بسیاری گروههای قطبی یا یونی و هیدروفیلیک دیگر، بهراحتی با آب برهمکنش داده و در فاز آبی توزیع میشوند، از اینرو آنها را پلیمرهای هیدروفیلیک یا بهطور سادهتر “هیدروکلوئیدها” مینامند، که قادرند یک سیستم کلوئیدی برگشتپذیر (reversible colloid system) تشکیل دهند.
سلهای حلالگریز (lyophobic sols): این اصطلاح به معنی مایعگریز است. موادی که تمایل پیوندی زیادی با محیط دیسپرسیون ندارند و بههنگام مخلوط شدن با محیط، بهراحتی به حالت سل درنمیآیند، کلوئیدهای آبگریز (hydrophobic colloids) نامیده میشوند. سلهای اینگونه مواد با استفاده از تکنیکهای خاصی آماده شده و آنها را سلهای آبگریز (hydrophobic sols) مینامند. سلهای فلزاتی مانند طلا، پلاتینیوم و غیره، و سلهای مواد نامحلول نظیر سولفیدها و اکسیدهای فلزی، نمونههایی از سلهای حلالگریز هستند. سلهای حلالگریز در مقایسه با سلهای حلالدوست پایداری نسبتا کمتری دارند. آنها بهسادگی با افزودن مقادیر کمی الکترولیتها، همراه با گرمادهی یا همزدن ترسیب مییابند (یا لخته میشوند). بهعلاوه، فاز پراکنده پس از ترسیب، نمیتواند بهسادگی با اختلاط آن با محیط دیسپرسیون به حالت سل برگردد. برای همین سلهای آبگریز تحت عنوان سلهای برگشتناپذیر (irreversible sols) نیز شناخته میشوند. سلهای حلالگریز نیازمند عوامل پایدارکننده بوده تا بتوانند برای مدت طولانی در شکل سل باقی بمانند.